Wykorzystanie mikroorganizmów w nauce i przemyśle
Kwas mlekowy znajdujący się w mleku dzięki fermentacji mlekowej powoduje koagulację białek, w tym kazeiny. W ten sposób przetworzone mleko można przeznaczyć na produkcję także innych przetworów, takich jak: masło, śmietana, jogurt naturalny lub kefir [17] (fot. 2).
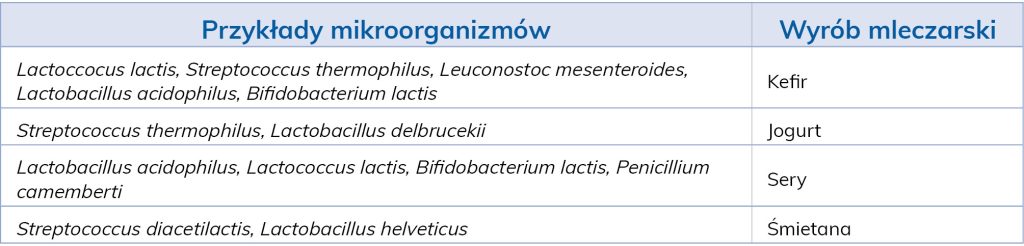
Wspomniany diacetyl przysłuży się w maśle, nadając mu jego intensywny, charakterystyczny zapach, alkohol etylowy nada aromatu w produkcji kefiru, a aldehyd octowy – jogurtom (tab. 1).
W tym momencie należałoby zaznaczyć, że fermentacja jest procesem oddychania beztlenowego mikroorganizmów. Jednakże drobnoustroje chętnie wykorzystywane są również dzięki ich metabolizmowi tlenowemu, np. drożdże piekarnicze Saccharomyces cerevisiae. Gatunek ten cechuje się przede wszystkim krótkim czasem generacji oraz zdolnością produkcji enzymów hydrolizujących cukry [...]
którzy są subskrybentami naszego portalu.
i ciesz się dostępem do bazy merytorycznej wiedzy!





























