Legionella spp. – występowanie i wykrywanie
Wykrywanie i oznaczanie liczby bakterii Legionella spp.
W Rozporządzeniu Ministra Zdrowia z dnia 7 grudnia 2017 r. podano zalecane normy, którymi należy posługiwać się w celu prawidłowego wykrywania bakterii Legionella spp. [11]. Najnowsza norma PN-EN ISO 11731:2017-08 Jakość wody − Oznaczanie ilościowe bakterii z rodzaju Legionella dostępna jest w angielskiej wersji językowej. Po opublikowaniu przez Polski Komitet Normalizacyjny w języku polskim normy PN-EN ISO 11731, poprzednie normy dotyczące wykrywania tych bakterii, tj. PN-EN ISO 11731-2:2008 oraz PN-ISO 11731:2002, mogą być stosowane nie dłużej niż 6 miesięcy. Najnowsza norma obejmuje metody hodowli w celu izolacji i oznaczania liczby bakterii z rodzaju Legionella dla różnych rodzajów wód − wody przeznaczonej do spożycia przez ludzi: wody przemysłowej, ścieków oraz wód naturalnych. Przedstawiona metodyka może być również zastosowana do badania innych próbek związanych ze środowiskiem wodnym, np. biofilmów lub osadów [13]. Informacje o pochodzeniu i cechach próbki są istotne przy właściwym wyborze metody badania (tab. 3).
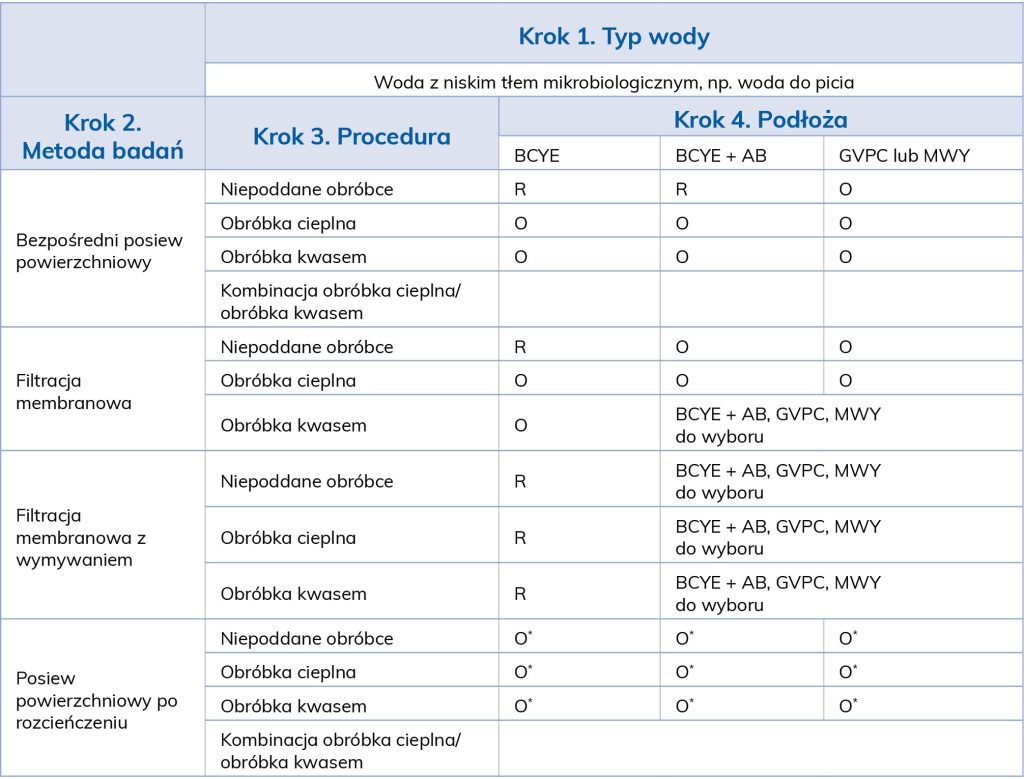
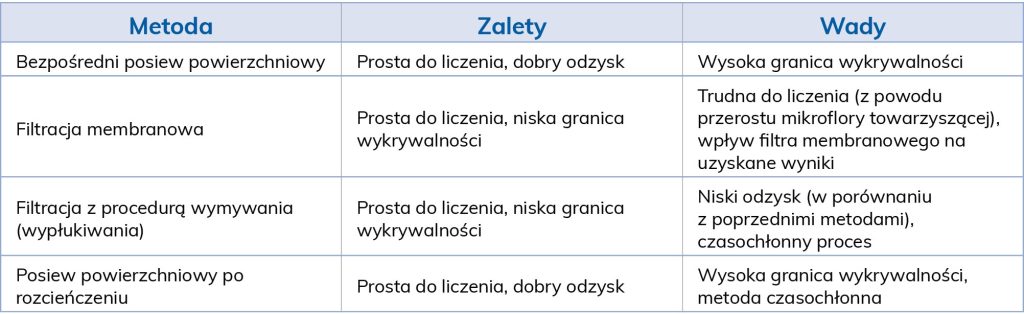
Znajomość dolnej granicy (progu detekcji) wykrywalności stosowanych metod oraz ich wad i zalet pozwoli pracownikom laboratorium na uniknięcie błędów oraz uzyskanie wiarygodnych wyników badań (tab. 4).
Woda o przypuszczalnie niskim poziomie niepożądanej mikroflory towarzyszącej, np. woda do picia, zawierająca przypuszczalnie wysoką liczbę bakterii Legionella spp., powinna być badana przy wykorzystaniu metody bezpośredniego posiewu powierzchniowego, natomiast gdy w próbce wody spodziewamy się niskiej liczby bakterii z rodzaju Legionella, należy zastosować metodę filtracyjną. Próbki wody z przewidywanym dużym zanieczyszczeniem mikroflory towarzyszącej, np. z systemów chłodzących, zraszających, jednostek dentystycznych, powinny być rozcieńczone tak, aby umożliwić detekcję pałeczek Legionella. W przypadku wód o wyjątkowo dużej liczbie mikroflory niepożądanej, zakłócającej odczyt badania, próbki powinny być poddane obróbce obejmującej działanie podwyższonej temperatury (50 ± 1°C) i kwasu (pH = 2,2 ± 2). Stosując filtrację membranową, należy wybrać odpowiednią membranę, a to zależy od wykorzystywanej procedury. W przypadku zatężania i wymywania zalecane są filtry poliwęglanowe lub polieterosulfonowe o średnicy porów 0,2 µm. Przy filtracji klasycznej stosowane są membrany z azotanu celulozy lub z mieszanych estrów celulozy o wielkości porów 0,2 µm lub 0,45 µm. Warto rozważyć też zastosowanie czarnych filtrów membranowych, gdyż pozwoli to na dokładniejszą obserwację makroskopową wyrosłych kolonii [13].
Pożywki, warunki inkubacji, badania potwierdzające
Do izolacji bakterii Legionella stosuje się agarowe podłoże BCYE agar (ang. Buffered Charcoal Yeast Extract agar) z węglem drzewnym i ekstraktem drożdżowym, zawierające L-cysteinę i pirofosforan żelaza (III). Aby zahamować wzrost mikroflory niepożądanej, występującej w badanej próbce, dodawane są trzy różne antybiotyki. W pożywce BCYE + AB agar suplement stanowią: siarczan polimyksyny B, sól sodowa cefazoliny oraz piramycyna (syn. natamycyna). Z kolei nazwa pożywki GVPC pochodzi od jej czterech składników: glicyny (wolnej od amoniaku), siarczanu polimyksyny B, chlorowodorku wankomycyny i cykloheksamidu. W wysoko selektywnym podłożu MWY (zmodyfikowany Wadowski, Yee) jako suplementy stosuje się glicynę, trzy antybiotyki: siarczan polimyksyny B, chlorowodorek wankomycyny i anisomycynę oraz dwa indykatory pH: błękit bromokrezolowy i purpurę bromokrezolową. Zaszczepione podłoża należy inkubować w 36 ± 2°C przez 7 do 10 dni w wilgotnej atmosferze. W czasie inkubacji po 2, 3, 4, 5 dniach i na koniec okresu inkubacji dokonuje się obserwacji wzrostu kolonii. Bakterie Legionella spp. rosną w postaci biało-szarych kolonii, ale mogą również występować w innych kolorach. Pod wpływem światła ultrafioletowego niektóre gatunki wykazują niebiesko-białą lub czerwoną autofluorescencję. Kolonie są gładkie, z charakterystycznym szklistym brzegiem. Po inkubacji dokonuje się badań potwierdzających dla charakterystycznych kolonii wyrosłych na podłożach selektywnych, polegających na sprawdzeniu ich wymagań wzrostowych w stosunku do L-cysteiny i żelaza(III) z wykorzystaniem dwóch podłoży BCYE agar i BCYE-cys agar (bez L-cysteiny), które może być zastąpione agarem z krwią owczą lub końską (blood agar), agarem odżywczym (nutrient agar) lub agarem tryptonowo-sojowym (tryptone soy agar). Hodowle inkubuje się w temperaturze 36 ± 2°C przez 2 do 5 dni. Za Legionella spp. należy uznać kolonie, które wykazały wzrost na podłożu z cysteiną, a nie rosną na podłożu bez cysteiny [13]. W przypadku identyfikacji do gatunku należy wykonać badania serologiczne lub genetyczne.
Test Legiolert®
Alternatywną metodą wykrywania bakterii Legionella spp. w stosunku do pracochłonnych i wymagających ogromnego doświadczenia procedur normatywnych jest test Legiolert®. Test ten otrzymał prestiżowy certyfikat francuskiej organizacji normalizacyjnej AFNOR (Association Française de Normalisation) o numerze referencyjnym No IDX 33/06-06/19. Pozwala to laboratoriom na korzystanie z tej metody bez konieczności kosztownej i czasochłonnej walidacji [14]. Test Legiolert® może być stosowany do wykrywania bakterii L. pneumophila w próbkach wody o różnym poziomie zanieczyszczenia. Wyniki uzyskuje się, podobnie jak w przypadku innych testów typu „lert” (Colilert, Enterolert, Pseudalert), w postaci najbardziej prawdopodobnej liczby (NPL). Zastosowanie odpowiedniego substratu w teście Legiolert® pozwala na wykrycie enzymu wskazującego na obecność żywych komórek L. pneumophila. Składniki odżywcze pozwalają na szybkie namnażanie się oznaczanych bakterii, co pozwala na otrzymanie wyniku w ciągu 7 dni, bez konieczności przeprowadzania dodatkowych badań potwierdzających. Każde brązowe zabarwienie oraz/lub zmętnienie w celkach tacki Quanti-Tray wskazuje na obecność L. pneumophila. Prostota wykonania testu znacząco usprawnia pracę w laboratorium, pozwala na szybsze niż w przypadku tradycyjnych metod hodowlanych uzyskanie odpowiedzi, czy w badanej próbce są obecne chorobotwórcze bakterie z gatunku L. pneumophila (rys. 2).

Podsumowanie
W celu przeciwdziałania występowania chorób wodozależnych został wprowadzony obowiązek badania obecności pałeczek Legionella spp. w ciepłej wodzie użytkowej oraz w wodzie w basenach [11, 12]. Jednak w związku z niewielką koncentracją komórek bakterii Legionella spp. w stosunku do mikroflory towarzyszącej, a także ze względu na specyficzne wymagania odżywcze i powolny wzrost, wykrywanie tych bakterii stanowi poważny problem. Dobór właściwej metody i procedury wykonania badań pozwala na otrzymanie wyników przedstawiających rzeczywisty stan zagrożenia zdrowotnego. Warto rozważyć tu zastosowanie alternatywnych, posiadających udokumentowaną procedurę walidacyjną metod skracających czas uzyskania bardzo ważnego wyniku w kontekście zarządzania bezpieczeństwem mikrobiologicznym wody.
Piśmiennictwo
- World Health Organization: Legionella and the prevention of legionellosis. 2007, https://www.who.int › water_sanitation_health › emerging › legionella [dostęp 2.09.2019].
- Bédard E., Paranjape K., Lalancette C., Villion M., Quach C., Laferrière C., Faucher S.P., Prévost M.: Legionella pneumophila levels and sequence-type distribution in hospital hot water samples from faucets to connecting pipes. „Water Research”, 2019, 156, 277-286.
- Palusińska-Szysz M., Cendrowska-Pinkosz M.: Występowanie i chorobotwórczość bakterii z rodziny Legionellaceae. „Postępy Higieny i Medycyny Doświadczalnej”, 2008, 62, 337-353.
- Palusińska-Szysz M., Drożański W.J.: Patogeneza i czynniki wirulencji pałeczek z rodziny Legionellaceae, „Postępy Higieny i Medycyny Doświadczalnej”, 2006, 60, 24-44.
- Gabińska-Łoniewska A., Siński E.: Mikroorganizmy chorobotwórcze i potencjalnie chorobotwórcze w ekosystemach wodnych i sieciach wodociągowych. Wydawnictwo Seidler-Przywecki Sp. z o.o., Warszawa 2010.
- Mekkour M., Driss E.K.B., Tai J., Cohen N.: Legionella pneumophila: An Environmental Organism and Accidental Pathogen. „International Journal of Science and Technology”, 2013, 2, 2, 187-196.
- Sikora A., Wójtowicz-Bobini M., Sikora A., Kozioł-Montewka M., Strzelec-Nowak D.: Charakterystyka mikrobiologiczna bakterii z rodzaju Legionella: klasyfikacja, morfologia i fizjologia, czynniki wirulencji – część I. „Forum Zakażeń”, 2014, 5 (1), 17-25.
- Steinert M., Hentschel U., Hacker J.: Legionella pneumophila: an aquatic microbe goes astray. „FEMS Microbiology Reviews”, 2002, 26, 149-162.
- Europejska Sieć Nadzoru nad Chorobą Legionistów(ELDSNet). Dokument techniczny ECDC. Procedury operacyjne. Sztokholm 2012. http://www.wsse.olsztyn.pl/pliki/epidemiologia/ELDSNet.pdf [dostęp 11.09.2019].
- Rozporządzenie Ministra Zdrowia z dnia 22 kwietnia 2005 r. w sprawie szkodliwych czynników biologicznych dla zdrowia w środowisku pracy oraz ochrony zdrowia pracowników zawodowo narażonych na te czynniki (Dz.U. 2005, Nr 81, Poz. 716).
- Rozporządzenie Ministra Zdrowia z dnia 7 grudnia 2017 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi (Dz.U. z dnia 11 grudnia 2017 r., Poz. 2294).
- Rozporządzenie Ministra Zdrowia z dnia 9 listopada 2015 r. w sprawie wymagań, jakim powinna odpowiadać woda na pływalniach (Dz.U. z dnia 2 grudnia 2015 r., Poz. 2016).
- PN-EN ISO 11731:2017-08 Jakość wody − Oznaczanie ilościowe bakterii z rodzaju Legionella.
- IDEXX, Legiolert https://www.idexx.pl/pl/water/water-products-services/legiolert/ [dostęp 5.09.2019].