Precyzja w służbie bezpieczeństwa. Klasyczne miareczkowanie alkacymetryczne jako alternatywa dla potencjometrycznego oznaczania zawartości nikotyny w produktach nikotynowych
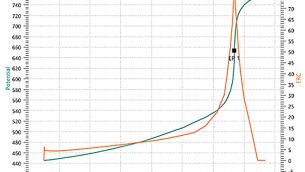
Potencjometryczne oznaczanie nikotyny opiera się o zmiany potencjału elektrody w czasie miareczkowania roztworu nikotyny w środowisku lodowatego kwasu octowego przy użyciu kwasu nadchlorowego jako titrantu. Przygotowanie próbki polega na rozcieńczeniu naważki produktu zawierającego nikotynę w zlewce szklanej za pomocą około 30 ml lodowatego kwasu octowego, następnie rozcieńczoną próbkę umieszcza się na mieszadle magnetycznym zintegrowanego zestawu do miareczkowania potencjometrycznego. W zlewce z próbką umieszcza się końcówkę biurety titratora oraz elektrodę mierzącą zmiany potencjału w trakcie dodawania titrantu, którym jest 0,1-molowy kwas nadchlorowy, uprzednio zmianowany. Na postawie wartości potencjału elektrody zmieniającego się w czasie generowana jest krzywa odpowiedzi elektrody, której punkt przegięcia wyznacza punkt końcowy miareczkowania [9].
Niewątpliwymi zaletami tej metody są brak konieczności stosowania roztworów barwnych oraz duża dokładność i powtarzalność. Metoda ta jest niewrażliwa na obecność zanieczyszczeń oraz różnorodną matrycę próbki (w przypadku e-liquidów obecność aromatów, słodzików i chłodzików), a co za tym idzie – złożoność próbki nie jest przeszkodą w oznaczeniu.
Objętość titrantu, jaka została użyta do osiągniecia punktu końcowego miareczkowania, przelicza się na stężenie nikotyny w badanej próbce.
Oznaczanie nikotyny z wykorzystaniem klasycznego miareczkowania alkacymetrycznego
Klasyczne miareczkowanie alkacymetryczne jest jedną z najstarszych i najczęściej stosowanych metod analizy ilościowej w chemii. Polega ono na oznaczaniu stężenia kwasów lub zasad poprzez ich zobojętnianie roztworem titrantu o dokładnie znanym stężeniu. Podstawą tej metody jest reakcja kwasu z zasadą, która przebiega stechiometrycznie według równania neutralizacji, prowadząc do powstania wody i odpowiedniej soli. Próbkę zawierającą oznaczany składnik umieszcza się w kolbie stożkowej i dodaje do niej odpowiedni wskaźnik barwny, czyli substancję zmieniającą barwę w określonym przedziale pH. Następnie za pomocą biurety powoli dodaje się roztwór titrantu – mocnego kwasu, gdy analizuje się zasadę, albo mocnej zasady, gdy oznacza się kwas – aż do momentu, w którym ilość dodanego titrantu jest chemicznie równoważna ilości oznaczanego składnika. Punkt równoważnikowy wyznacza się dzięki zmianie barwy wskaźnika, która zachodzi w momencie, gdy pH roztworu gwałtownie się zmienia. Wybór wskaźnika zależy od siły kwasu i zasady biorących udział w reakcji, na przykład do miareczkowania mocnych kwasów mocnymi zasadami stosuje się najczęściej fenoloftaleinę lub oranż metylowy, ponieważ ich zakresy zmiany barwy dobrze pokrywają się z zakresem skoku pH. Po odczytaniu objętości zużytego titrantu i znajomości jego stężenia oblicza się ilość substancji oznaczanej zgodnie z prawem zachowania masy i stechiometrią reakcji.
Miareczkowanie alkacymetryczne znajduje szerokie zastosowanie zarówno w analizie czystych substancji, jak i w badaniu próbek środowiskowych, farmaceutycznych czy spożywczych. Metoda ta charakteryzuje się prostotą wykonania, dużą dokładnością oraz możliwością zastosowania do oznaczania zarówno mocnych, jak i słabych kwasów oraz zasad, pod warunkiem odpowiedniego doboru titrantu i wskaźnika. Dzięki swojej uniwersalności i łatwości interpretacji wyników stanowi podstawową technikę ilościowej analizy chemicznej w laboratoriach na całym świecie [10].
W celu zastosowania tej metody do oznaczania nikotyny w próbkach, podobnie jak w schemacie postępowania dla analiz potencjometrycznych, zastosowano te same zakresy dla naważek próbek e-liquidów oraz tożsame rozcieńczenie 30 ml lodowatego kwasu octowego. Ze względu na charakter zasadowy nikotyny, ale i bardzo kwaśne środowisko reakcji, jako wskaźnik wykorzystano roztwór wodny fioletu krystalicznego.
Fiolet krystaliczny, nazywany także fioletem gencjanowym lub methylrosanilinium chloratum, jest organicznym barwnikiem kationowym należącym do grupy barwników trifenylometanowych. Występuje w postaci ciemnofioletowego, połyskującego proszku lub kryształów, które dobrze rozpuszczają się w wodzie i etanolu, tworząc intensywnie zabarwione roztwory o charakterystycznej fioletowej barwie. Substancja ta jest światłoczuła, co oznacza, że pod wpływem promieniowania słonecznego ulega powolnemu rozkładowi i blaknięciu. Fiolet krystaliczny od dawna znajduje zastosowanie zarówno w biologii, jak i w medycynie oraz chemii analitycznej. W mikrobiologii jest podstawowym barwnikiem w metodzie Grama, umożliwiającej różnicowanie bakterii Gram-dodatnich i Gram-ujemnych, a także służy do obserwacji struktur komórkowych w preparatach mikroskopowych. W medycynie wykazuje właściwości antyseptyczne i przeciwgrzybicze, dlatego dawniej stosowany był miejscowo w leczeniu infekcji skóry i błon śluzowych, choć obecnie jego użycie w tym zakresie zostało znacznie ograniczone ze względu na dostępność nowszych, bezpieczniejszych preparatów. W chemii analitycznej wykorzystuje się go jako wskaźnik pH, ponieważ zmienia barwę w zakresie kwaśnym i zasadowym, co umożliwia kontrolę przebiegu reakcji zobojętniania. Dzięki intensywnej barwie fiolet krystaliczny jest także stosowany jako barwnik w przemyśle tekstylnym i papierniczym. Pomimo jego szerokiego zastosowania należy pamiętać, że może działać drażniąco i potencjalnie toksycznie, dlatego w pracy laboratoryjnej wymaga zachowania ostrożności [11].
Zmiana barwy podczas miareczkowania jest dość trudna do wychwycenia i nie tak jednoznaczna jak przegięcie krzywej odpowiedzi elektrody, ale odpowiednia ilość wskaźnika w proporcji do objętości roztworu pozwala na zaobserwowanie zmiany barwy z fioletowej na niebieską przy punkcie końcowym. Co więcej, przemiareczkowanie jest również widoczne w postaci przejścia barwy w turkus, potem kolejno w zieleń, aż do żółci.
Titrantem w tej metodzie, podobnie jak przy miareczkowaniu potencjometrycznym, jest kwas nadchlorowy 0,1 M, który powinien być zmianowany za pomocą wodoroftalanu potasu. W miarę postępu miareczkowania uzyskujemy analogiczne zmian barwy jak opisane powyżej. Miano przeliczono z poniższej zależności:
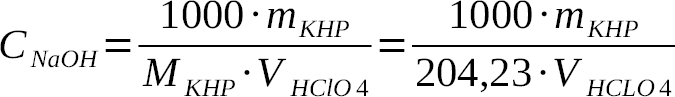
gdzie:
Chclo4 – szukane stężenie kwasu nadchlorowego [M],
1000 – przelicznik ml na l,
mKHP – masa naważki wodorftalanu potasu [g],
MKHP – masa molowa wodoroftalanu potasu [g/mol],
Vhclo4 – objętość zużytego kwasu nadchlorowego [ml].
Wykonanie analizy dla badanych próbek przebiega w sposób następujący: naważkę próbki rozcieńcza się w kolbie stożkowej Erlenmayera za pomocą lodowatego kwasu octowego, następnie dodaje się kroplę wodnego roztworu fioletu krystalicznego i prowadzi się miareczkowanie z użyciem biurety automatycznej napełnionej uprzednio zmianowanym roztworem kwasu nadchlorowego dozowanego kroplami, z równoczesnym mieszaniem próbki w kolbie w celu równomiernego zachodzenia reakcji barwnej.
Zmiana barwy następuje w sposób łatwy do wychwycenia, a użytą objętość titrantu przeliczamy na zawartość nikotyny zgodnie z następującą zależnością:
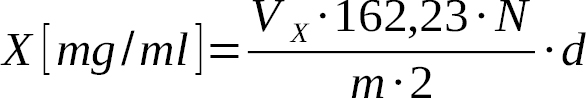
gdzie:
m – naważka [mg],
Vx – objętość titrantu potrzebna do zmiereczkowania roztworu próbki [ml],
N – miano roztworu kwasu nadchlorowego,
d – gęstość próbki [g/cm3].
Podsumowanie
Ewolucja rynku wyrobów nikotynowych postawiła przed sektorem laboratoryjnym i medycznym nowe, duże wyzwania. Wzrost popularności produktów takich jak e-liquidy czy saszetki nikotynowe wraz z wprowadzeniem rygorystycznych regulacji prawnych stworzył silne zapotrzebowanie na precyzyjne metody analizy ilościowej nikotyny. Ta potrzeba wynika bezpośrednio z nadrzędnego celu, jakim jest ochrona zdrowia publicznego.
Jak wykazano w niniejszym artykule, chociaż nowoczesne techniki chromatograficzne, takie jak HPLC i GC, są uznawanymi standardami w analizie ilościowej, ich złożoność, wysoki koszt i wrażliwość na specyficzne cechy matryc (takie jak aromaty w e-liquidach) mogą stanowić barierę dla rutynowej kontroli jakości. W obliczu tych wyzwań klasyczne metody analityczne, w szczególności miareczkowanie alkacymetryczne w środowisku niewodnym, jawią się jako niezawodna i ekonomicznie efektywna alternatywa.
Wykorzystanie titratora potencjometrycznego pozwala na osiągnięcie wysokiej precyzji, a także na uniknięcie subiektywności wizualnej oceny punktu końcowego, podczas gdy metoda klasyczna, oparta na obserwacji zmiany barwy wskaźnika, pozostaje niezastąpiona ze względu na prostotę wykonania i niskie koszty. Obydwie te metody są wysoce odporne na interferencje ze strony matrycy, co jest ich kluczową przewagą w kontekście analizy produktów o złożonym składzie.
Podsumowując, w erze szybkiego postępu technologicznego podstawy chemii analitycznej wciąż stanowią fundament precyzyjnej i wiarygodnej kontroli. Miareczkowanie, choć jest jedną z najstarszych technik, wciąż ma wiele do zaoferowania. Pozostaje niezawodnym narzędziem, które zapewnia, że cele regulacji prawnych i dbałości o bezpieczeństwo użytkowników są skutecznie osiągane w praktyce laboratoryjnej.
Piśmiennictwo
- Dani J.A., De Biasi M.: Cellular mechanisms of nicotine addiction. „Pharmacology Biochemistry and Behavior”, 2001, 70(4), 439-446.
- Benowitz N.L.: Nicotine addiction. „New England Journal of Medicine”, 2010, 362(24), 2295-2303.
- Govind A.P., Vezina P., Green W.N.: Nicotine-induced upregulation of nicotinic receptors: underlying mechanisms and relevance to nicotine addiction. „Biochemical Pharmacology”, 2009, 78(7), 756-765.
- Slotkin T.A.: Nicotine and the adolescent brain: insights from an animal model. „Neurotoxicology and Teratology”, 2002, 24(3), 369–384.
- Yuan M., Cross S.J., Loughlin S.E., Leslie F.M.: Nicotine and the adolescent brain. „Journal of Physiology”, 2015, 593(16), 3397–3412.
- Benowitz N.L., Burbank A.D.: Cardiovascular toxicity of nicotine: Implications for electronic cigarette use. „Trends in Cardiovascular Medicine”, 2016, 26(6), 515–523.
- American Heart Association: Electronic nicotine delivery systems: a policy statement. „Circulation”, 2014, 129(19), 1972–1986.
- Ustawa z dnia 21 maja 2025 r. o zmianie ustawy o ochronie zdrowia przed następstwami używania tytoniu i wyrobów tytoniowych (Dz.U. 2025, poz. 799).
- European Pharmacopoeia 11.8, 2.2.20: Potentiometric titration.
- Harris D.C.: Quantitative Chemical Analysis. 9th ed., W.H. Freeman and Company, New York 2015.
- Adams E.: The antibacterial action of crystal violet. „Journal of Pharmacy and Pharmacology”, 1967, 19(12), 821-826.