Derywatyzacja w chromatografii gazowej. Przegląd metod i reagentów
Acylowanie
Odczynniki acylujące mają szczególne znaczenie w analizie związków, zawierających w swej strukturze grupy hydroksylowe lub aminowe, szczególnie jeśli nie ulegają one łatwo reakcjom sililowania. Spośród dostępnych odczynników, najczęściej stosowane są bezwodniki kwasów organicznych, począwszy od bezwodnika octowego, używane są także bezwodniki stosunkowo mocnych kwasów zawierających atomy fluoru w strukturze [16-18]. Dodatkowo można je zastosować w przypadku planowanej detekcji ECD, co zwiększy możliwość analizy związków obecnych w niskich stężeniach. Pewne zastosowanie mają także perfluorowane chlorki acylowe oraz nieliczne inne odczynniki, np. N-metylo-bis(trifluoroacetamid) (MBTFA). O ile znaczna część odczynników jest stosunkowo agresywna chemicznie, o tyle warunki prowadzenia reakcji są łagodne – w wielu przypadkach wystarczająca jest temperatura pokojowa. Struktury powszechnie stosowanych reagentów są przedstawione na rys. 3.
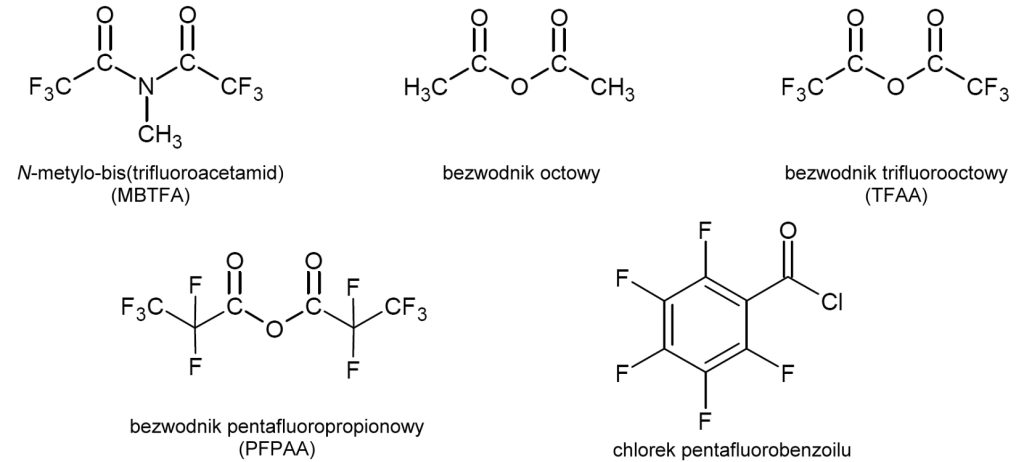
Pochodne acylowe różnego rodzaju są chętnie stosowane jako alternatywa pochodnych sililowych w analizie steroli, triterpenoli, a także alkoholi drugo- [...]
którzy są subskrybentami naszego portalu.
i ciesz się dostępem do bazy merytorycznej wiedzy!





























